The direct conversion of A to B is difficult and thus it is converted by path ACDB. Given
Where e.u. is the entropy unit, then is:
1. +60 e.u
2. +100 e.u
3. -60 e.u
4. -100 e.u
A से B का सीधा रूपांतरण मुश्किल है और इस प्रकार यह पथ A CDB द्वारा परिवर्तित होता है। दिया गया है

जहाँ e.u. एंट्रॉपी इकाई है, तब है:
(1) +60 e.u
(2) +100 e.u
(3) -60 e.u
(4) 100 e.u
The free energy change =0 when:-
(1) the system is at equilibrium
(2) Catalyst is added
(3) Reactants are initially mixed throughly
(4)The reactants are completely consumed
मुक्त ऊर्जा परिवर्तन = 0 है जब:-
(1) निकाय साम्यावस्था पर है
(2) उत्प्रेरक मिलाया जाता है
(3) अभिकारकों को प्रारंभ मेंअच्छी तरह से मिलाया जाता है
(4) अभिकारक पूर्णतया खप जाते हैं
A Beckmann thermometer is used to measure
1. High temperature
2. Low temperature
3. Normal temperature
4. All temperature
एक बेकमान थर्मामीटर का उपयोग किसे मापने के लिए किया जाता है?
1. उच्च तापमान
2. कम तापमान
3. सामान्य तापमान
4. सभी तापमान
If a gas absorbs 200 J of heat and expands by 500
cm against constant pressure of 2 x 10 Nm-2 then
change in internal energy is
1. 200 J
2. 100J
3. +100J
4. + 300J
यदि कोई गैस 200J को अवशोषित कर लेती है और 2 x 105 Nm-2 के स्थिर दाब पर 500cm3 तक प्रसारित की जाती है तो आंतरिक ऊर्जा में परिवर्तन है:
1. 200 J
2. 100J
3. +100J
4. +300J
Assume each reaction is carried out in an open container, For which reaction
1.
2.
3.
4.
मान लीजिए कि प्रत्येक अभिक्रिया एक खुले कंटेनर में की जाती है, किस अभिक्रिया के लिए
1.
2.
3.
4.
H—H bond energy: 431.37 kJ mol-1
C =C bond energy: 606.10 kJ mol-1
C—C bond energy: 336.49 kJ mol-1
C—H bond energy: 410.50 kJ mol-1

H—H बंध ऊर्जा : 431.37 kJ mol-1
C =C बंध ऊर्जा : 606.10 kJ mol-1
C—C बंध ऊर्जा : 336.49 kJ mol-1
C—H बंध ऊर्जा : 410.50 kJ mol-1

Which one of the following statements is false?
1. temperature is a state function
2. work is a state function
3. Change in the state is completely defined when the initial and final states are specified
4. work appears at the boundary of the system
निम्नलिखित में से कौन सा कथन गलत है?
1. तापमान एक अवस्था फलन है
2. कार्य एक अवस्था फलन है
3. प्रारंभिक और अंतिम अवस्थाएँ निर्दिष्ट होने पर अवस्था में परिवर्तन पूरी तरह से परिभाषित होता है
4. कार्य निकाय की सीमा पर दिखाई देता है
The net work done for an ideal gas is given as
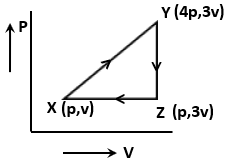
1. 3PV
2. 3PV
3. PV
4. Zero
एक आदर्श गैस के लिए किए गए कुल कार्य को किस प्रकार दिया गया है:
1. 3PV
2. 3PV
3. PV
4. शून्य
The bond dissociation enthalpy of gaseous H2, Cl2 and HCl are 435, 243 and 431 kJ mol-1, respectively. Calculate the enthalpy of formation of HCl gas.
1. -92 kJ mol-1
2. -82 kJ mol-1
3. -21 kJ mol-1
4. -55 kJ mol-1
गैसीय H2, Cl2 और HCl के बंध वियोजन एन्थैल्पी क्रमशः 435, 243 और 431 kJ mol-1 हैं। HCl गैस के निर्माण की एन्थैल्पी की गणना कीजिए।
1. -92 kJ mol-1
2. -82 kJ mol-1
3. -21 kJ mol-1
4. -55 kJ mol-1
The molar entropy of the vapourization of acetic acid is 14.4 cal K-1 mol-1 at its boiling point . The latent heat of vapourization of acetic acid is
1. 49 cal g-1
2. 64 cal g-1
3. 94 cal g-1
4. 84 cal g-1
एसीटिक अम्ल के वाष्पन के अवशोषण की मोलर एंट्रॉपी इसके क्वथनांक पर 144.4 cal K-1 mol-1 है। एसीटिक अम्ल के वाष्पन की गुप्त ऊष्मा है-
1. 49 cal g-1
2. 64 cal g-1
3. 94 cal g-1
4. 84 cal g-1






