Assume each reaction is carried out in an open container, For which reaction
1.
2.
3.
4.
मान लीजिए कि प्रत्येक अभिक्रिया एक खुले कंटेनर में की जाती है, किस अभिक्रिया के लिए
1.
2.
3.
4.
H—H bond energy: 431.37 kJ mol-1
C =C bond energy: 606.10 kJ mol-1
C—C bond energy: 336.49 kJ mol-1
C—H bond energy: 410.50 kJ mol-1

H—H बंध ऊर्जा : 431.37 kJ mol-1
C =C बंध ऊर्जा : 606.10 kJ mol-1
C—C बंध ऊर्जा : 336.49 kJ mol-1
C—H बंध ऊर्जा : 410.50 kJ mol-1

Which one of the following statements is false?
1. temperature is a state function
2. work is a state function
3. Change in the state is completely defined when the initial and final states are specified
4. work appears at the boundary of the system
निम्नलिखित में से कौन सा कथन गलत है?
1. तापमान एक अवस्था फलन है
2. कार्य एक अवस्था फलन है
3. प्रारंभिक और अंतिम अवस्थाएँ निर्दिष्ट होने पर अवस्था में परिवर्तन पूरी तरह से परिभाषित होता है
4. कार्य निकाय की सीमा पर दिखाई देता है
The net work done for an ideal gas is given as
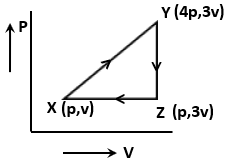
1. 3PV
2. 3PV
3. PV
4. Zero
एक आदर्श गैस के लिए किए गए कुल कार्य को किस प्रकार दिया गया है:
1. 3PV
2. 3PV
3. PV
4. शून्य
The bond dissociation enthalpy of gaseous H2, Cl2 and HCl are 435, 243 and 431 kJ mol-1, respectively. Calculate the enthalpy of formation of HCl gas.
1. -92 kJ mol-1
2. -82 kJ mol-1
3. -21 kJ mol-1
4. -55 kJ mol-1
गैसीय H2, Cl2 और HCl के बंध वियोजन एन्थैल्पी क्रमशः 435, 243 और 431 kJ mol-1 हैं। HCl गैस के निर्माण की एन्थैल्पी की गणना कीजिए।
1. -92 kJ mol-1
2. -82 kJ mol-1
3. -21 kJ mol-1
4. -55 kJ mol-1
The molar entropy of the vapourization of acetic acid is 14.4 cal K-1 mol-1 at its boiling point . The latent heat of vapourization of acetic acid is
1. 49 cal g-1
2. 64 cal g-1
3. 94 cal g-1
4. 84 cal g-1
एसीटिक अम्ल के वाष्पन के अवशोषण की मोलर एंट्रॉपी इसके क्वथनांक पर 144.4 cal K-1 mol-1 है। एसीटिक अम्ल के वाष्पन की गुप्त ऊष्मा है-
1. 49 cal g-1
2. 64 cal g-1
3. 94 cal g-1
4. 84 cal g-1
One mole of ice is converted into the water at 273 K. The entropies of H2O(s) and H2O(l) are 38.20 and 60.01 J mol-1K-1 respectively. The enthalpy change for the conversion is:
1. 59.54 J mol-1
2. 5954 J mol-1
3. 595.4 J mol-1
4. 320.6 J mol-1
बर्फ का एक मोल 273 K पर जल में परिवर्तित हो जाता है। H2O(s) और H2O (l) की एन्ट्रॉपियाँ क्रमशः 38.20 और 60.01 J mol-1K-1 हैं। रूपांतरण के लिए एन्थैल्पी परिवर्तन है:
(1) 59.54 J mol-1
(2) 5954 J mol-1
(3) 595.4 J mol-1
(4) 320.6 J mol-1
The entropy change in the fusion of one mole of a solid melting at 27C (the latent heat of fusion is 2930 J mol-1) is
1. 9.77 JK-1mol-1
2. 10.73 JK-1mol-1
3. 2930 JK-1mol-1
4. 108.5 JK-1mol-1
27C में एक ठोस के पिघलने से एक मोल के संलयन में एन्ट्रापी परिवर्तन (संलयन की गुप्त ऊष्मा 2930 J mol-1 है) है
(1) 9.77 JK-1mol-1
(2) 10.73 JK-1mol-1
(3) 2930 JK-1mol-1
(4) 108.5 JK-1mol-1
Standard entropies of X2, Y2 and XY3 are 60, 40 and 50 J K-1mol-1 respectively. For the reaction
X2, Y2 और XY3 की मानक एंट्रॉपियाँ क्रमशः 60, 40 और 50 J K-1mol-1 हैं।
State which of the following statements is true ?
1. First law of thermodynamics is not adequate in predicting the direction of the process.
2. In an exothermic reaction, the total enthalpy of the products is greater than that of reactants.
3. The standard enthalpy of diamond is zero at 298 K and 1 atm pressure.
4. It is possible to calculate the value of for the reaction from the bond enthalpy data.
निम्नलिखित में से कौन सा कथन सही है?
1. उष्मागतिकी का पहला नियम प्रक्रम की दिशा की अनुमानित करने के लिए पर्याप्त नहीं है।
2. एक ऊष्माक्षेपी अभिक्रिया में, उत्पादों की कुल एन्थैल्पी अभिकर्मकों की तुलना में अधिक है।
3. 298 K और 1 atm दाब पर हीरे की मानक एन्थैल्पी शून्य होती है।
4. बंध एन्थैल्पी आकड़े से अभिक्रिया के लिए के मान की गणना करना संभव है।






