For a reaction at equilibrium-
1.
2.
3.
4.
साम्यावस्था पर अभिक्रिया के लिए-
1.
2.
3.
4.
The pair of isochoric among the transformation of state is:
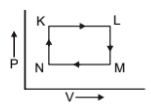
1. K to L and L to M
2. L to M and N to K
3. L to M and M to N
4. M to N and N to K
अवस्था के परिवर्तन के बीच समआयतनिक का युग्म है:
1. K से L और L से M
2. L से M और N से K
3. L से M और M से N
4. M से N और N से K
Which of the following is not an endothermic reaction?
1. combustion of methane
2. decomposition of water
3. dehydrogenation of ethane or ethylene
4. conversion of graphite to diamond
निम्नलिखित में से कौन-सी ऊष्माशोषी अभिक्रिया नहीं है?
1. मेथेन का दहन
2. जल का अपघटन
3. एथेन या एथिलीन का विहाइड्रोजनीकरण
4. ग्रेफाइट का हीरा में रूपांतरण
If S for H2, Cl2 and HCl are 0.13, 0.22 and 0.19 kJ K-1mol-1 respectively. The total change in standard entropy for the reaction, H2 + Cl2 2HCl is:
1. 30 J K-1mol-1
2. 40 J K-1mol-1
3. 60 J K-1mol-1
4. 20 J K-1mol-1
यदि H2, Cl2 और HCl के लिए S क्रमशः 0.13, 0.22 और 0.19 kJ K-1mol-1 हैं। अभिक्रिया H2 + Cl2 2HCl के लिए मानक एंट्रॉपी में कुल परिवर्तन है:
(1) 30 J K-1mol-1
(2) 40 J K-1mol-1
(3) 60 J K-1mol-1
(4) 20 J K-1mol-1
Work done in the reversible adiabatic process is given by:
1. 2.303 RT log (V2/V1)
2.
3. 2.303 RT log(V1/V2)
4. none of these
उत्क्रमणीय रुद्धोष्म प्रक्रम में किया गया कार्य निम्न द्वारा दिया जाता है:
(1) 2.303 RT log (V2/V1)
(2)
(3) 2.303 RT log(V1/V2)
(4) इनमें से कोई नहीं
Plants and living beings are examples of
1. isolated system
2. adiabatic system
3. open system
4. closed system
पौधे और जीवित प्राणी किसके उदाहरण हैं?
1. विलगित निकाय
2. रूद्धोष्म निकाय
3. खुला निकाय
4. बंद निकाय
For the reaction, 2Cl(g) Cl2(g), the correct option is:
1.
2.
3.
4.
अभिक्रिया, 2Cl(g) Cl2(g) के लिए, सही विकल्प है:
1.
2.
3.
4.
Point out the wrong statement in relation to enthalpy
(1) It is a state function
(2) It is an intensive property
(3) It is independent of the path followed for the change
(4) Its value depends upon the amount of substance in the system
एन्थैल्पी के संबंध में गलत कथन को इंगित कीजिए
(1) यह एक अवस्था फलन है
(2) यह एक गहन गुण है
(3) यह परिवर्तन के लिए अपनाए गए पथ से स्वतंत्र है
(4) इसका मान निकाय में पदार्थ की मात्रा पर निर्भर करता है
For the isothermal expansion of an ideal gas
(1) E and H increases
(2) E increases but H decreases
(3) H increases but E decreases
(4) E and H are unaltered
एक आदर्श गैस के समतापीय प्रसार के लिए
(1) E और H बढ़ता है
(2) E बढ़ता है लेकिन H घटता है
(3) H बढ़ता है लेकिन E घटता है
(4) E और H स्थिर हैं
One mole of an ideal gas is allowed to expand freely and adiabatically into vacuum until its volume has doubled. A statement which is not true concerning this expression is [Pb. PMT 1998]
(1) ΔH = 0
(2) ΔS = 0
(3) ΔE = 0
(4) W = 0
एक आदर्श गैस के एक मोल को स्वतंत्र रूप से और रुद्धोष्म ढंग से निर्वात में प्रसरण करने की अनुमति दी जाती है जब तक कि इसकी आयतन दोगुना न हो जाए। एक बयान जो इस व्यंजक के संबंध में सही नहीं है: [Pb. PMT 1998]
(1) ΔH = 0
(2) ΔS = 0
(3) ΔE = 0
(4) W = 0






