The amount of heat measured for a reaction in a bomb calorimeter is
(1) ΔG
(2) ΔH
(3) ΔE
(4) PΔV
बम कैलोरीमीटर में अभिक्रिया के लिए मापी गई ऊष्मा की मात्रा है [AIIMS 1991]
(1) ΔG
(2) ΔH
(3) ΔE
(4) PΔV
The heat liberated when 1.89 g of benzoic acid is burnt in a bomb calorimeter at 25°C increases the temperature of 18.94 kg of water by 0.632°C. If the specific heat of water at 25°C is 0.998 cal/g-deg, the value of the heat combustion of benzoic acid is
(1) 771.1 kcal
(2) 871.2 kcal
(3) 881.1 kcal
(4) 981.1 kcal
25°C पर बम कैलोरीमीटर में 1.89 g बेंजोइक अम्ल जलने पर उष्मा मुक्त हो जाती है, जिससे 0.632°C से 18.94 kg जल का तापमान बढ़ जाता है। यदि 25°C पर जल की विशिष्ट ऊष्मा 0.998 cal/g-deg है, तो बेंजोइक अम्ल के ऊष्मा दहन का मान है:
(1) 771.1kcal
(2) 871.2kcal
(3) 881.1kcal
(4) 981.1kcal
In thermodynamics, a process is called reversible when
(1) Surroundings and system change into each other
(2) There is no boundary between system and surroundings
(3) The surroundings are always in equilibrium with the system
(4) The system changes into the surroundings spontaneously
ऊष्मागतिकी में, किसी प्रक्रम को उत्क्रमणीय कहा जाता है जब [AIIMS 2001]
(1) परिवेश और निकाय एक दूसरे में बदलते हैं
(2) निकाय और परिवेश के बीच कोई सीमा नहीं है
(3) परिवेश निकाय के साथ हमेशा साम्यावस्था में होता है
(4) निकाय स्वत परिवेश में बदल जाता है
A solution of 500 ml of 0.2 M KOH and 500 ml of 0.2 M HCl is mixed and stirred; the rise in temperature is T1. The experiment is repeated using 250 ml each of solution, the temperature raised is T2. Which of the following is true
(1) T1 = T2
(2) T1 = 2T2
(3) T1 = 4T2
(4) T2 = 9T1
0.2 M KOH के 500 ml और 0.2 M HCl के 500 ml विलयन को मिश्रित और विलोड़ित किया जाता है; तापमान में वृद्धि T1 है। प्रयोग विलयन के प्रत्येक 250 ml का उपयोग करके दोहराया जाता है, तो बढ़ा हुआ तापमान T2 है। निम्नलिखित में से कौन सा सही है: [EAMCET 1987; MP PET 1994]
(1) T1 = T2
(2) T1 = 2T2
(3) T1 = 4T2
(4) T2 = 9T1
The bond energies of, C-H, H-H and C=C are 198, 98, 103 and145 kcal respectively. The enthalpy change of the reaction is
1. 48 kcal
2. 96 kcal
3. -40 kcal
4. -152 kcal
, C-H, H-H और C = C की बंध ऊर्जाएँ क्रमशः 198, 98, 103 और 145 kcal हैं। अभिक्रिया का एन्थैल्पी परिवर्तन है:
1. 48 kcal
2. 96 kcal
3. -40 kcal
4. -152 kcal
For a reaction at equilibrium-
1.
2.
3.
4.
साम्यावस्था पर अभिक्रिया के लिए-
1.
2.
3.
4.
The pair of isochoric among the transformation of state is:
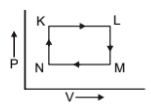
1. K to L and L to M
2. L to M and N to K
3. L to M and M to N
4. M to N and N to K
अवस्था के परिवर्तन के बीच समआयतनिक का युग्म है:
1. K से L और L से M
2. L से M और N से K
3. L से M और M से N
4. M से N और N से K
Which of the following is not an endothermic reaction?
1. combustion of methane
2. decomposition of water
3. dehydrogenation of ethane or ethylene
4. conversion of graphite to diamond
निम्नलिखित में से कौन-सी ऊष्माशोषी अभिक्रिया नहीं है?
1. मेथेन का दहन
2. जल का अपघटन
3. एथेन या एथिलीन का विहाइड्रोजनीकरण
4. ग्रेफाइट का हीरा में रूपांतरण
If S for H2, Cl2 and HCl are 0.13, 0.22 and 0.19 kJ K-1mol-1 respectively. The total change in standard entropy for the reaction, H2 + Cl2 2HCl is:
1. 30 J K-1mol-1
2. 40 J K-1mol-1
3. 60 J K-1mol-1
4. 20 J K-1mol-1
यदि H2, Cl2 और HCl के लिए S क्रमशः 0.13, 0.22 और 0.19 kJ K-1mol-1 हैं। अभिक्रिया H2 + Cl2 2HCl के लिए मानक एंट्रॉपी में कुल परिवर्तन है:
(1) 30 J K-1mol-1
(2) 40 J K-1mol-1
(3) 60 J K-1mol-1
(4) 20 J K-1mol-1
Work done in the reversible adiabatic process is given by:
1. 2.303 RT log (V2/V1)
2.
3. 2.303 RT log(V1/V2)
4. none of these
उत्क्रमणीय रुद्धोष्म प्रक्रम में किया गया कार्य निम्न द्वारा दिया जाता है:
(1) 2.303 RT log (V2/V1)
(2)
(3) 2.303 RT log(V1/V2)
(4) इनमें से कोई नहीं






