The slopes of isothermal and adiabatic curves are related as -
(1) Isothermal curve slope = adiabatic curve slope
(2) Isothermal curve slope = γ × adiabatic curve slope
(3) Adiabatic curve slope = γ × isothermal curve slope
(4) Adiabatic curve slope = isothermal curve slope
समतापीय और रुद्धोष्म वक्र की ढलाने सम्बंधित है-
(1) समतापीय वक्र ढलान = रुद्धोष्म वक्र ढलान
(2) समतापीय वक्र ढलान= γ × रुद्धोष्म वक्र ढलान
(3) रुद्धोष्म वक्र ढलान = γ ×समतापीय वक्र ढलान
(4) रुद्धोष्म वक्र ढलान =समतापीय वक्र ढलान
A monoatomic ideal gas, initially at temperature T1, is enclosed in a cylinder fitted with a frictionless piston. The gas is allowed to expand adiabatically to a temperature T2 by releasing the piston suddenly. If L1 and L2 are the lengths of the gas column before and after expansion respectively, then T1/ T2 is given by -
(1)
(2)
(3)
(4)
एक एकपरमाणुक आदर्श गैस, प्रारंभ में तापमान T1 पर एक घर्षण रहित पिस्टन वाले सिलेंडर में परिबद्ध है। पिस्टन को अचानक निर्मुक्त करके गैस को रूद्धोष्म ढंग से तापमान T2 तक प्रसारित कर दिया जाता है। यदि प्रसार से पहले और बाद में गैस स्तंभ की लंबाई क्रमशः L1 और L2 है, तब T1/ T2 निम्न द्वारा दिया गया है -
(1)
(2)
(3)
(4)
The P-V diagram shows seven curved paths (connected by vertical paths) that can be followed by a gas. Which two of them should be parts of a closed cycle if the net work done by the gas is to be at its maximum value
1. ac
2. cg
3. af
4. cd
P-V आरेख सात वक्र पथों (ऊर्ध्वाधर पथों से जुड़े हुए) को दर्शाता है जिसका अनुसरण एक गैस द्वारा किया जा सकता है। यदि गैस द्वारा किया गया परिणामी कार्य अधिकतम हो तो उनमें से कौन से दो पथ एक बंद चक्र के भाग होने चाहिए?
1. ac
2. cg
3. af
4. cd
An ideal gas is taken from point A to the point B, as shown in the P-V diagram. The work done in the process is -
1.
2.
3.
4.
एक आदर्श गैस को बिंदु A से बिंदु B तक ले जाया जाता है, जैसा कि P-V आरेख में दिखाया गया है। प्रक्रम में किया गया कार्य है:
1.
2.
3.
4.
An ideal gas A and a real gas B have their volumes increased from V to 2 V under isothermal conditions. The increase in internal energy
(1) Will be same in both A and B
(2) Will be zero in both the gases
(3) Of B will be more than that of A
(4) Of A will be more than that of B
एक आदर्श गैस A और एक वास्तविक गैस B के आयतन V से 2V तक समतापीय स्थितियों के अंतर्गत बढ़ाये जाते हैं। आंतरिक ऊर्जा में वृद्धि :
(1) A और B दोनों में समान होगी
(2) दोनों गैसों में शून्य होगी
(3) B की A से अधिक होगी
(4) A की B से अधिक होगी
A Container having 1 mole of a gas at a temperature 27°C has a movable piston which maintains constant pressure in container of 1 atm. The gas is compressed until temperature becomes 127°C. The work done is (Cp for gas is 7.03 cal/mol K)
(1) 703 J
(2) 814 J
(3) 121 J
(4) 2035 J
एक बर्तन मे 1 मोल गैस 27°C ताप पर भरी गई है। यह गैस एक मुक्त पिस्टन से परिबद्ध है जो बर्तन मे 1 atm नियत दाब बनाये रखता है। गैस को संपीडित किया जाता है जब तक तापमान 127°C हो जाता है। किया गया कार्य है (गैस के लिए Cp 7.03 cal/mol Kहै)
(1) 703 J
(2) 814 J
(3) 121 J
(4) 2035J
Work done by a system under isothermal change from a volume V1 to V2 for a gas which obeys Vander Waal's equation
(1)
(2)
(3)
(4)
एक गैस के लिए V1 आयतन से V2 तक समतापी परिवर्तन के तहत एक निकाय द्वारा किया गया कार्य जिसमे गैस वान्डर वाल्स के समीकरण का पालन करती है
(1)
(2)
(3)
(4)
P-V diagram of a diatomic gas is a straight line passing through origin. The molar heat capacity of the gas in the process will be -
1. 4 R
2. 2.5 R
3. 3 R
4.
किसी द्विपरमाणुक गैस के लिए P-V आरेख मूलबिंदु से गुजरने वाली एक सरल रेखा है। इस प्रक्रम में गैस की मोलर ऊष्मा धारिता होगी -
(1) 4R
(2) 2.5R
(3) 3R
(4)
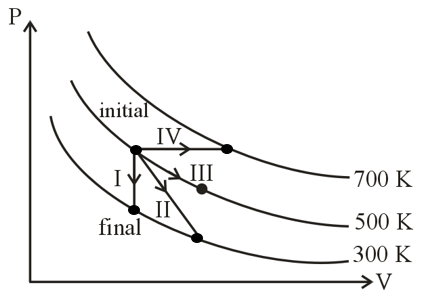
Match the following
Column-I Column-II
P. Process I a. Adiabatic
Q. Process II b. Isobaric
R. Process III c. Isochoric
S. Process IV d. Isothermal

निम्नलिखित का मिलान कीजिए
स्तम्भ-I स्तंभ-II
P. प्रक्रम I रुद्धोष्म
Q. प्रक्रम II समदाबीय
R. प्रक्रम III समआयतनिक
S. प्रक्रम IV समतापीय
In the following P-V diagram two adiabatics cut two isothermals at temperatures T1 and T2 (fig.). The value of will be
(1)
(2)
(3)
(4) VbVc
निम्नलिखित P-V आरेख में दो रुद्धोष्म वक्र तापमान T1 और T2 (आकृति) पर दो समतापी वक्रों को काटते हैं। का मान होगा :
(1)
(2)
(3)
(4) VbVc










