Saturated solution of KNO3 is used to make 'salt-bridge' because:
1. velocity of K+ is greater than that of
2. velocity of is greater than that of K+
3. Velocities of both K+ and are nearly the same
4. KNO3 is highly soluble in water
KNO3 का संतृप्त विलयन 'लवण-सेतु' बनाने के लिए उपयोग किया जाता है क्योंकि:
(1) K+ का वेग की तुलना में अधिक है
(2) का वेग K+ की तुलना में अधिक है
(3) दोनों K+ और का वेग लगभग समान हैं
(4) KNO3 जल में अत्यधिक घुलनशील है
E0 for Fe2+ + 2e → Fe is -0.44 volt and E0 for Zn2+ + 2e→ Zn is -0.76 volt, thus:
1. Zn is more electropositive than Fe
2. Fe is more electropositive than Zn
3. Zn is more electronegative
4. none of the above
Fe2+ + 2e → Fe के लिए E0 -0.44 वोल्ट और Zn2+ + 2e→ Zn के लिए E0 -0.76 वोल्ट है, इसप्रकार:
(1) Z, Fe की तुलना में अधिक विद्युतधनात्मक है
(2) Fe, Zn की तुलना में अधिक विद्युतधनात्मक है
(3) Zn अधिक विद्युतऋणात्मक है
(4) उपरोक्त में से कोई नहीं
During the charging of lead storage battery, the reaction at anode is represented by:
1.
2.
3.
4.
लेड संचायक बैटरी आवेशित करने के दौरान, एनोड पर अभिक्रिया द्वारा दर्शाया जाता है:
(1)
(2)
(3)
(4)
At , the standard emf of cell having reactions involving two electron change is found to be 0.295 V. The equilibrium constant of the reaction is-
पर, दो इलेक्ट्रॉन परिवर्तन युक्त सेल वाले अभिक्रियाओं का मानक emf 0.295 V पाया जाता है। अभिक्रिया का साम्यावस्था स्थिरांक है-
If the half-cell reaction A+eA- has a large negative reduction potential, it follows that:
1. A is readily reduced
2. A is readily oxidized
3. A- is readily reduced
4. A- is readily oxidized
यदि अर्ध सेल अभिक्रिया A+eA- में अधिक ऋणात्मक अपचयन विभव होता है, यह इस प्रकार है:
(1) A आसानी से अपचयित हो जाता है
(2) A आसानी से ऑक्सीकृत हो जाता है
(3) A- आसानी से अपचयित हो जाता है
(4) A- आसानी से ऑक्सीकृत हो जाता है
The cell reaction of micro electrochemical cell fromed during rusting of iron is:-
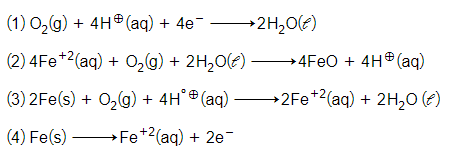
लोहे में जंग लगने के दौरान बनने वाली सूक्ष्म वैद्युतरासायनिक सेल की सेल अभिक्रिया है: -
When 0.1 mole of MnO2-4 is oxidised, the quantity of electricity required to completely oxidise MnO2-4 to MnO-4 is
1. 96500 C
2. 2*96500 C
3. 9650 C
4. 96.50 C
जब MnO2-4 का 0.1 मोल ऑक्सीकृत किया जाता है, MnO2-4 से MnO-4 को पूर्णतया ऑक्सीकृत करने के लिए आवश्यक विद्युत की मात्रा है-
(1) 96500 C
(2) 2*96500 C
(3) 9650 C
(4) 96.50 C
When a lead storage battery is discharged, then:
1. SO2 is evolved
2. lead is formed
3. lead sulphate is consumed
4. sulphuric acid is consumed
जब एक लेड संचायक बैटरी को विसर्जित किया जाता है, तो:
(1) SO2 उत्पन्न होती है
(2) लेड बनता है
(3) लेड सल्फेट का उपभोग किया जाता है
(4) सल्फ्यूरिक अम्ल का उपभोग किया जाता है
, the standard emf of the reaction
will be
1. 0.111V
2. 0.330V
3. 1.653V
4. 1.212V
,
If the E°cell for a given reaction has a negative value, which of the following gives correct relationships for the values of G° and Keq ?
(1) G° >0; Keq< 1
(2) G° >0; Keq>1
(3) G° < 0; Keq> 1
(4) G° <0; Keq< 1
यदि दी गई अभिक्रिया के लिए E°सेल का ऋणात्मक मान है, तो निम्नलिखित में से कौन G° और Kतुल्यांक के मानों के लिए सही संबंध देता है?
(1) G° >0; Kतुल्यांक < 1
(2) G° >0; Kतुल्यांक >1
(3) G° < 0; Kतुल्यांक > 1
(4) G° <0; Kतुल्यांक < 1






