At , the standard emf of cell having reactions involving two electron change is found to be 0.295 V. The equilibrium constant of the reaction is-
पर, दो इलेक्ट्रॉन परिवर्तन युक्त सेल वाले अभिक्रियाओं का मानक emf 0.295 V पाया जाता है। अभिक्रिया का साम्यावस्था स्थिरांक है-
If the half-cell reaction A+eA- has a large negative reduction potential, it follows that:
1. A is readily reduced
2. A is readily oxidized
3. A- is readily reduced
4. A- is readily oxidized
यदि अर्ध सेल अभिक्रिया A+eA- में अधिक ऋणात्मक अपचयन विभव होता है, यह इस प्रकार है:
(1) A आसानी से अपचयित हो जाता है
(2) A आसानी से ऑक्सीकृत हो जाता है
(3) A- आसानी से अपचयित हो जाता है
(4) A- आसानी से ऑक्सीकृत हो जाता है
The cell reaction of micro electrochemical cell fromed during rusting of iron is:-
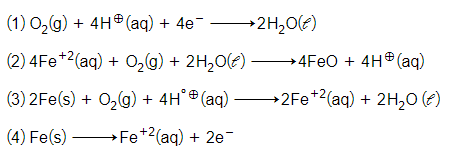
लोहे में जंग लगने के दौरान बनने वाली सूक्ष्म वैद्युतरासायनिक सेल की सेल अभिक्रिया है: -
When 0.1 mole of MnO2-4 is oxidised, the quantity of electricity required to completely oxidise MnO2-4 to MnO-4 is
1. 96500 C
2. 2*96500 C
3. 9650 C
4. 96.50 C
जब MnO2-4 का 0.1 मोल ऑक्सीकृत किया जाता है, MnO2-4 से MnO-4 को पूर्णतया ऑक्सीकृत करने के लिए आवश्यक विद्युत की मात्रा है-
(1) 96500 C
(2) 2*96500 C
(3) 9650 C
(4) 96.50 C
When a lead storage battery is discharged, then:
1. SO2 is evolved
2. lead is formed
3. lead sulphate is consumed
4. sulphuric acid is consumed
जब एक लेड संचायक बैटरी को विसर्जित किया जाता है, तो:
(1) SO2 उत्पन्न होती है
(2) लेड बनता है
(3) लेड सल्फेट का उपभोग किया जाता है
(4) सल्फ्यूरिक अम्ल का उपभोग किया जाता है
, the standard emf of the reaction
will be
1. 0.111V
2. 0.330V
3. 1.653V
4. 1.212V
,
If the E°cell for a given reaction has a negative value, which of the following gives correct relationships for the values of G° and Keq ?
(1) G° >0; Keq< 1
(2) G° >0; Keq>1
(3) G° < 0; Keq> 1
(4) G° <0; Keq< 1
यदि दी गई अभिक्रिया के लिए E°सेल का ऋणात्मक मान है, तो निम्नलिखित में से कौन G° और Kतुल्यांक के मानों के लिए सही संबंध देता है?
(1) G° >0; Kतुल्यांक < 1
(2) G° >0; Kतुल्यांक >1
(3) G° < 0; Kतुल्यांक > 1
(4) G° <0; Kतुल्यांक < 1
What is the value of if for 0.04 of a at ?
(A) 9.3
(B) 9.2
(C) 4.7
(D) 4.8
(1) 9.3
(2) 9.2
(3) 4.7
(4) 4.8
Zinc can be coated on iron to produce galvanised iron but the reverse is not possible. It is because
(1) zinc is lighter than iron
(2) zinc has lower melting point than iron
(3) zinc has lower negative electrode potential than iron
(4) zinc has higher negative electrode potential than iron
यशदलेपित लोहे का उत्पादन करने के लिए ज़िंक को लोहे पर लेपित किया जा सकता है लेकिन उत्क्रम संभव नहीं है इसकी वजह यह है
(1) ज़िंक लोहे की तुलना में हल्का होता है
(2) ज़िंक में लोहे की तुलना में कम गलनांक होता है
(3) ज़िंक में लोहे की तुलना में कम ऋणात्मक इलेक्ट्रोड विभव होता है
(4) ज़िंक में लोहे की तुलना में अधिक ऋणात्मक इलेक्ट्रोड विभव होता है
A dilute solution of was electrolysed by passing a current of 2 amp. The time required for formation of 0.5 mole of oxygen is
(1) 26.8 hours
(2) 13.4 hours
(3) 6.7 hours
(4) 28.6 hours
का एक तनु विलयन 2 एम्पीयर की धारा पारित करके विद्युतअपघट्य किया गया। ऑक्सीजन के 0.5 मोल के निर्माण के लिए आवश्यक समय है
(1) 26.8 घंटे
(2) 13.4 घंटे
(3) 6.7 घंटे
(4) 28.6 घंटे






