Heats of combustion of are -890, -1411 and -1560 kJ/mole respectively. Which has the lowest fuel value in kJ/gm ?
1.
2.
3.
4. All same
के दहन का ऊष्माएँ क्रमशः -890, -1411 और -1560 kJ/mole हैं। किसमें kJ/gm में सबसे कम ईंधन मान होता है?
1.
2.
3.
4. सभी समान
If (i) , (ii) , (iii) , the heats of reaction are Q, –12, –10 respectively. Then Q = [Orissa JEE 2004]
(1) – 2
(2) 2
(3) – 22
(4) – 16
यदि (i) , (ii) , (iii) , अभिक्रिया की ऊष्माएँ क्रमश: Q, –12, –10 हैं। तब Q = [Orissa JEE 2004]
(1) – 2
(2) 2
(3) – 22
(4) – 16
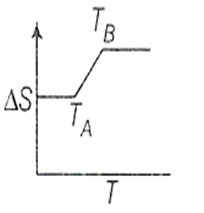
If for a given substance melting point is TB and freezing point is TA, then correct variation shown by graph between entropy change and temperature is [DCE 2001]
(1) 
(2)
(3)
(4)
यदि किसी दिए गए पदार्थ के लिए गलनांक TB और हिमांक TA है, फिर एंट्रॉपी परिवर्तन और तापमान के मध्य आरेख द्वारा दर्शाए गए सही परिवर्तन है: [DCE 2001]
(1)
(2)
(3)
(4)
Among the following, the reaction for which is-
1.
2.
3.
4.
निम्नलिखित में से, अभिक्रिया जिसके लिए है-
1.
2.
3.
4.
For a given reaction, H =35.5 kJmol-1 and S = 83.6JK-1 mol-1. The reaction is spontaneous at: (Assume that H and S do not vary with temperature)
(1) T < 425 K
(2) T >425 K
(3) all temperatures
(4) T >298 K
एक दी गई अभिक्रिया के लिए, H= 35.5 kJmol-1 और S= 83.6 JK-1 mol-1है। किस ताप पर अभिक्रिया स्वतः होती है: (मान लीजिए किH और S तापमान के साथ परिवर्तित नहीं होते है)
(1) T < 425 K
(2) T > 425 K
(3) सभी तापमान
(4) T >298 K
Using only the following data:
(I)
(II)
the value, in kilojoules, for the reaction
is calculated to be:
1. -43.3
2. -10.3
3. +6.2
4. +10.3
केवल निम्नलिखित आकड़े का उपयोग करने पर:
(I)
(II)
अभिक्रिया के लिए मान की किलोजूल में गणना कीजिए:
1. -43.3
2. -10.3
3. +6.2
4. +10.3
When a liquid boils, there is [JIPMER 2002]
(1) An increase in entropy
(2) A decrease in entropy
(3) An increase in heat of vaporization
(4) An increase in free energy
जब एक द्रव उबला जाता है, वहाँ पर: [जिपमेर 2002]
(1) एंट्रॉपी में वृद्धि
(3) एंट्रॉपी में कमी
(3) वाष्पीकरण की ऊष्मा में वृद्धि
(4) मुक्त ऊर्जा में वृद्धि
For the reaction at 25°C and 1 atm. pressure, ΔH = –874 kJ. Then the change in internal energy (ΔE) is …. [Orissa JEE 2002]
(1) – 874 kJ
(2) – 871.53 kJ
(3) – 876.47 kJ
(4) + 874 kJ
25°C और 1 atm दाब पर अभिक्रिया के लिए ΔH = –874 kJ है। तब आंतरिक ऊर्जा (ΔE) में परिवर्तन होता है... [Orissa JEE 2002]
(1) – 874 kJ
(2) – 871.53 kJ
(3) – 876.47 kJ
(4) + 874kJ
ΔE° of combustion of isobutylene is –X kJ mol–1. The value of ΔH° is [DCE 2004]
(1) = ΔE°
(2) > ΔE°
(3) = 0
(4) < ΔE°
आइसोब्यूटिलीन के दहन की ΔE°, –X kJ mol–1 है। ΔH° का मान है: [डीसीई 2004]
(1) = ΔE°
(2) > ΔE°
(3) = 0
(4) < ΔE°
At constant T and P, which one of the following statements is correct for the reaction,
(1) ΔH is independent of the physical state of the reactants of that compound
(2) ΔH > ΔE
(3) ΔH < ΔE
(4) ΔH = ΔE
स्थिर T और P पर, निम्नलिखित में से कौन सा एक कथन अभिक्रिया, के लिए सही है, [AIIMS 1982, 83; KCET 1988; BHU 1995; MP PET 1997, 99]
(1) ΔH यौगिक के अभिकारकों की भौतिक अवस्था से स्वतंत्र है
(2) ΔH > ΔE
(3) ΔH < ΔE
(4) ΔH = ΔE










