When 0.16 g of glucose was burnt in a bomb calorimeter, the temperature rose by 4 deg. Calculate the calorimeter constant (water equivalent of the calorimeter) given that [molar enthalpy of combustion]. Molar mass of glucose = 180 mol-1.
1.
2.
3.
4.
जब एक बम कैलोरीमीटर में 0.16 g ग्लूकोज जलाया गया, तो तापमान 4 डिग्री बढ़ गया। कैलोरीमीटर स्थिरांक (जल कैलोरीमीटर के तुल्य है) की गणना कीजिए, दिया है [दहन की मोलर एन्थैल्पी], ग्लूकोज का मोलर द्रव्यमान = 180 mol-1
1.
2.
3.
4.
The standard enthalpy of combustion at of hydrogen, cyclohexene (C6H10) and cyclohexane (C6H12) are -241, -3800 and -3920 kJ mol-1, respectively. Calculate the standard enthalpy of hydrogenation of cyclohexene.
1. -131 kJ mol-1
2. -155 kJ mol-1
3. -167 kJ mol-1
4. -121 kJ mol-1
पर हाइड्रोजन, साइक्लोहेक्सीन (C6H10) और साइक्लोहेक्सेन (C6H12) के दहन की मानक एन्थैल्पी क्रमश: -241, -3800 और -3920 kJ mol-1 हैं। साइक्लोहेक्सीन के हाइड्रोजनीकरण के मानक एन्थैल्पी की गणना कीजिए।
1. -131 kJ mol-1
2. -155 kJ mol-1
3. -167 kJ mol-1
4. -121 kJ mol-1
Heat of neutralisation of oxalic acid is -25.4 K cal mol-1 using strong base, NaOH. Hence enthalpy change of the process is is-
1. 2.0 kcal
2. -11.8 kcal
3. 1.0 kcal
4. -1.0 kcal
प्रबल क्षार, NaOH का उपयोग करने पर ऑक्सैलिक अम्ल के उदासीनीकरण की ऊष्मा -25.4 K K cal mol-1 है। इसलिए प्रक्रम की एन्थैल्पी परिवर्तन है-
1. 2.0 kcal
2. -11.8 kcal
3. 1.0 kcal
4. -1.0 kcal
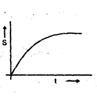
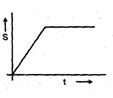
A copper block of mass `m' at temperature 'T1' is kept in the open atmosphere at temperature `T2' where T2 > T1 . The variation of entropy of the copperblock with time is best illustrated by
(1)
(2)
(3)
(4)
तापमान 'T1' पर द्रव्यमान `m' का एक कॉपर ब्लॉक तापमान 'T2' में खुले वातावरण में रखा जाता है, जहाँ T2 > T1 है। समय के साथ कॉपर ब्लॉक की एंट्रॉपी की भिन्नता किसके द्वारा सबसे अच्छी तरह से सचित्र है:
(1)
(2)
(3)
(4)
Fora perfectly crystalline solid Cpm = aT3, where a is constant. If Cpm is 0.42 J/K–mol at 10 K, molar entropy at 10 K is
(1) 0.42 J/K–mol
(2) 0.14 J/K–mol
(3) 4.2 J/K–mol
(4) zero
एक पूर्णतया क्रिस्टलीय ठोस Cpm = aT3, जहाँ a स्थिरांक है। यदि Cpm 10 K पर 0.42 J/K–mol है, 10 K पर मोलर एंट्रॉपी है:
(1) 0.42 J/K–mol
(2) 0.14 J/K–mol
(3) 4.2 J/K–mol
(4) शून्य
Which is correct at equilibrium?
1. H = 0 2. GTotal=0
3. STotal=0 4. E=0
साम्यावस्था पर कौन सा सही है?
1. H = 0 2. Gकुल = 0
3. Sकुल = 0 4. E = 0
One mole of an ideal monoatomic gas expands isothermally against constant external pressure of 1 atm from initial volume of 1L to a state where its final pressure becomes equal to external pressure. If initial temperature of gas is 300 K then total entropy change of system in the above process is :
[R = 0.082 L atm mol–1 K–1 = 8.3 J mo1–1K–1].
(1) 0
(2) Rln (24.6)
(3) Rln (2490)
(4) Rln(24.6)
एक आदर्श एकपरमाण्विक गैस का एक मोल, समतापीय रूप से 1L के प्रारंभिक आयतन से 1 atm के स्थिर बाहरी दाब के विरुद्ध उस अवस्था में विस्तारित है, जहाँ उसका अंतिम दाब बाहरी दाब के बराबर हो जाता है। यदि गैस का प्रारंभिक तापमान 300 K है तो उपरोक्त प्रक्रम में निकाय की कुल एंट्रॉपी परिवर्तन है:
[R = 0.082 L atm mol–1 K–1 = 8.3 J mo1–1K–1]
(1) 0
(2) Rln (24.6)
(3) Rln (2490)
(4) Rln(24.6)
Work done during isothermal expansion of one mole of an ideal gas from 10 atm to 1 atm at 300 K is (Gas constant = 2)
(1) 938.8 cal.
(2) 1138.8 cal.
(3) 1381.8 cal.
(4) 1581.8 cal.
300 K पर 10 atm से 1 atm तक एक आदर्श गैस के एक मोल के समतापीय प्रसार के दौरान किया गया कार्य है: (गैस स्थिरांक = 2) [AIIMS 2000]
(1) 938.8 cal
(2) 1138.8 cal
(3) 1381.8 cal
(4) 1581.8 cal
At 1000 K water vapour at 1 atm. has been found to be dissociated into H2 and O2 to the extent of 3 x 10–6 %.Calculate the free energy decrease of the system, assuming ideal behaviour.
(1) –ΔG = 90,060 cal
(2) –ΔG = 20 cal
(3) –ΔG = 480 cal
(4) –ΔG = –45760 cal
1 atm पर 1000 K पर जल वाष्प को H2 और O2 में 3 x 10-6 % की सीमा तक वियोजित पाया गया है। आदर्श व्यवहार मानकर, निकाय की मुक्त ऊर्जा में कमीकी गणना कीजिए।
(1) –ΔG = 90,060 cal
(2) –ΔG = 20 cal
(3) –ΔG = 480 cal
(4) –ΔG = –45760 cal
In the reaction for the transition of carbon in the diamond form to carbon in the graphite form, ΔH is –453.5 cal. This points out that
(1) Graphite is chemically different from diamond
(2) Graphite is as stable as diamond
(3) Graphite is more stable than diamond
(4) Diamond is more stable than graphite
ग्रेफाइट रूप में कार्बन को हीरे के रूप में कार्बन के संक्रमण के लिए अभिक्रिया में, ΔH -1453.5 cal है। यह इंगित करता है कि- [BHU 1981; KCET 1986, 89]
(1) ग्रेफाइट हीरे से रासायनिक रूप से भिन्न होता है
(2) ग्रेफाइट हीरे की तरह स्थायी होता है
(3) ग्रेफाइट हीरे की तुलना में अधिक स्थायी होता है
(4) हीरा ग्रेफाइट से अधिक स्थायी होता है